✧Как из батарейки CR2032 сделали аккумулятор ML2032. И что в итоге получилось
В принципе, любая химическая реакция обратима. Проблема только в том, что практически реализовать эту обратимость внутри данной электрохимической ячейки — еще та проблема.
Поэтому любая батарейка — это аккумулятор, который пока не смогли довести до ума.
А может, и никогда не доведут.
Внимание, тут будет много электрохимии — матери всех химических источников тока.
Несмотря на все ухищрения, часть материала получилась не самой читабельной. Но по другому нельзя — иначе изложение было бы нелогичным. За что автор искренне извиняется и предлагает не стрелять в пианиста.
Если раздел 4 не удастся осилить, то ничего страшного. Это нормально.
Во избежание недоразумений: сейчас в формате «2032» (20мм на 3.2мм) на рынке присутствуют следующие электрохимические системы:
• Li-MnO₂ ► батарейки CR2032 и аккумуляторы ML2032 — собственно, предмет дальнейшего обсуждения;
• Li-ion ► аккумуляторы LIR2032;
• Li-CFₓ ► батарейки ВR2032, про них было ТУТ, в самом начале. С точки зрения конечного пользователя — полный аналог CR2032, только дороже и (теоретически) чем-то замечательнее.
Примечание. Есть еще DL2032 (datasheet). Додумались до такого те же самые ребята, которые в далеком 1973-м создали антропоморфного розового кролика.
 Откуда там +70% мне не ведомо, ибо в даташите заявлены совершенно обычные «220 mAh on 15 kΩ to 2.0 V», а разрядные кривые на стандартных 0.2 мА (15 kΩ) фактически совпадают с таковыми для CR2032 от большинства остальных вендоров.
Откуда там +70% мне не ведомо, ибо в даташите заявлены совершенно обычные «220 mAh on 15 kΩ to 2.0 V», а разрядные кривые на стандартных 0.2 мА (15 kΩ) фактически совпадают с таковыми для CR2032 от большинства остальных вендоров.
Относительно некой «уникальности» DL2032, есть видеоролик с русскими субтитрами, который можно легко сократить до двух слов: макетологический развод.
Итак, есть система Li|электролит|MnO₂ и на ее основе издревле существует самая популярная батарейка-«монетка» CR2032. В конкурентах — только LR44, но в забугорной терминологии LR44 уже не «монетка», а «таблетка».;)
Не суть. Главное, что инженерам (химикам и технологам) еще в далеких 90-х была поставлена задача разработать на базе этой электрохимической системы аккумулятор. То есть, сделать гальванический элемент первого рода заметно обратимым (второго рода).
И они-таки сделали.
Прямого описания как такого добились, я пока не нашел (и вряд ли кто найдет).
Но много чего можно извлечь из косвенных данных. И выдвинуть некие предварительные предположения. Это будет в данной главе.
А в следующей — вскрытие ML в 2-х крайних состояниях заряженности и ряд моментов будет откорректировано.
Для начала нам понадобится 8 первоисточников:
[1] Аккумуляторы ML2032/ML2016/ML1220. Техническое описание от Maxell
[2] Аккумулятор ML2032: Даташит от Maxell
[3] Батарейки системы Li-MnO₂ от Maxell
[4] ML Battery: Product Safety Data Sheet от Maxell, 2010
[5] ML Battery: Product Safety Data Sheet от Maxell, 2025
[6] Перспективные катодные материалы для литий-ионных источников тока: преимущества и недостатки. «Альтернативная энергетика и экология» № 12, 2011
[7] ML2032:: Даташит от GUANGZHOU MARKYN BATTERY
[8] Каталог Maxell, 2025
①
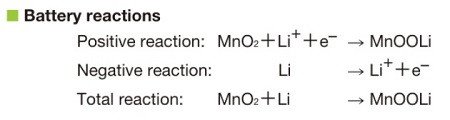
Сравним основные токообразующие реакции (фарадеевские процессы). Если совсем по-простому, то это примерно так:
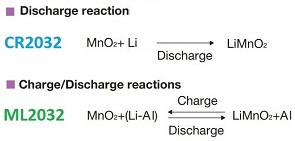 Принципиальной разницы никакой. При разряде в обоих случаях имеем [3]:
Принципиальной разницы никакой. При разряде в обоих случаях имеем [3]:
②
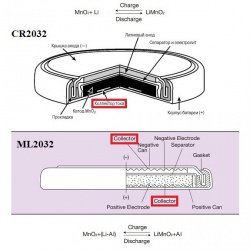
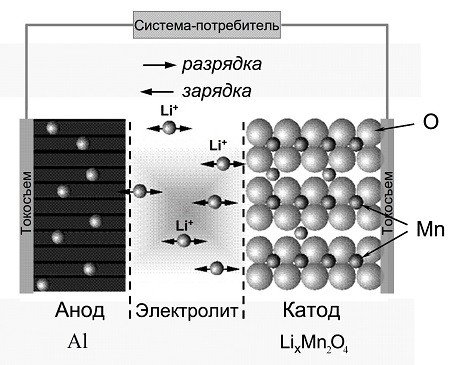
Зачем в ML алюминий? Порошок Al — носитель атомов Li. Типа как графит в Li-ion аккумуляторах. То, что анод порошкообразный легко догадаться, если сравнить две картинки:
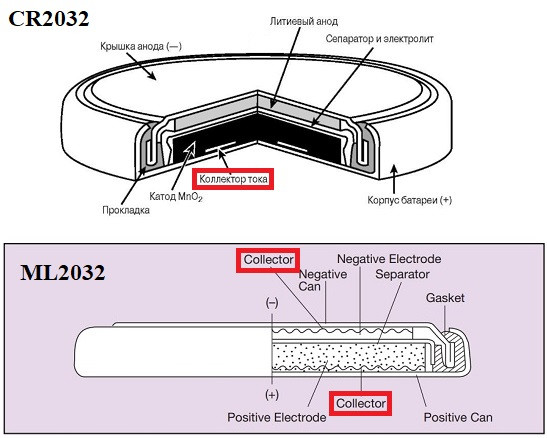 У CR2032 один коллектор тока (со стороны порошка MnO₂), а у ML2032 уже два.
У CR2032 один коллектор тока (со стороны порошка MnO₂), а у ML2032 уже два.
В CR2032 литий нанесён на минусовую крышку в виде компактной блямбы (см. предыдущую статью) и сама крышка выполняет роль коллектора. А в случае ML2032 порошкообразные электроды с двух сторон.
③
Какой состав системы (Al-Li+MnO₂)? Приблизительную оценку можно получить из [4]:
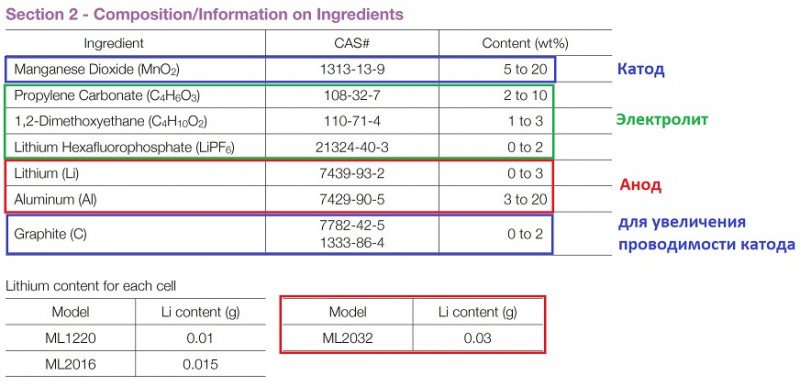 1) Если взять верхние значения, то m(Li):m(Al):m(MnO₂)=3:20:20
1) Если взять верхние значения, то m(Li):m(Al):m(MnO₂)=3:20:20
Если Li в системе 0.03 г, то Al — 0.20 г.
А соотношение Li и Al: 13% Li и 87% Al.
2) Соотношение по молям
n(3/6.9):n(20/27):n(20/87)=0.435:0.741:0.230=1:1.70:0.53
Обратите внимание, как мало (по молям) окислителя MnO₂ относительно восстановителя лития. Дело в том, что часть лития постоянно входит в состав катода LiₓMn₂O₄, независимо от уровня заряда ML. Это будет объяснено ниже.
④
Когда предыдущий пункт был полностью оформлен, я случайно забрел на сайт Maxell и с удивлением обнаружил наисвежайший ML Battery: Product Safety Data Sheet от 01.01.2025.
Теперь они декларируют такое:
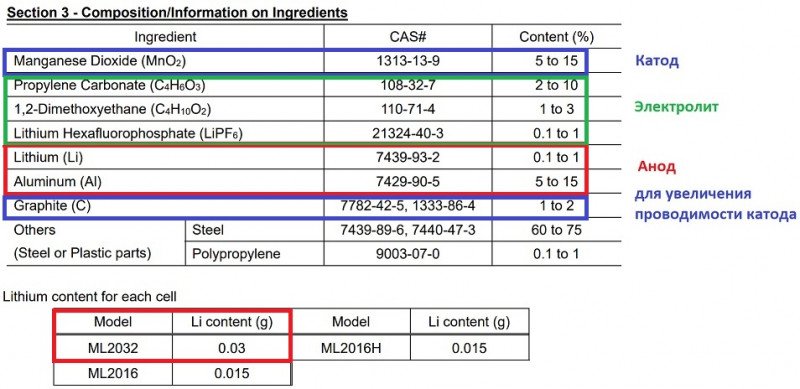 Радует, что представителям международных контролирующих органов удалось-таки объяснить составителям таблицы, что содержание базовых (абсолютно необходимых) компонентов не может начинаться с 0%.;) Кроме того, все-таки добавили данные по корпусу (сталь), уплотнителю + сепаратору (полипропилен).
Радует, что представителям международных контролирующих органов удалось-таки объяснить составителям таблицы, что содержание базовых (абсолютно необходимых) компонентов не может начинаться с 0%.;) Кроме того, все-таки добавили данные по корпусу (сталь), уплотнителю + сепаратору (полипропилен).
В Product Safety производители вынуждены заявлять хотя бы сильно приблизительный состав компонентов ячеек. Иначе аккредитацию не пройдут и соответствующий значок не получат. Но при этом точная «рецептура» — есть коммерческая тайна. Правда, куда как меньшая, чем «хау ит мейд» (технология изготовления).
⑤
Пока могу предположить как делают ML-аккумуляторы, начиная с 1996 г. (Maxell)
Изначально анод (-) представляет собой слегка отпрессованный мелкодисперсный порошок Al. Типа алюминиевой пудры, но специально обработанной для увеличения площади поверхности и удаления избытка защитной пленки оксида алюминия.
А катод (+) изначально — слабо отпрессованный мелкодисперсный порошок шпинели LiMn₂O₄.
После герметизации ячейки производят первичный заряд. Часть лития уходит на (-) и покрывает поверхность алюминиевой матрицы.
План был такой
1) Купить пару ML2032. Желательно с надписью «Maxell»***.
✅ Выполнено:
2) Купить более-менее вменяемую универсальную индикаторную бумагу
✅ Выполнено:

3) Один ML зарядить до упора. Другой — разрядить «практически в ноль». После этого вскрыть, взвесить «минусовые» крышки и бросить их в воду. Вынуть, высушить, взвесить. В общем, все как в предыдущем материале. Единственное отличие — замерить pH получившихся растворов.
4) Обработать полученные результаты, посмотреть как оно там устроено и, возможно, просчитать состав анода.
Разряжал 9 суток (без 2 часов) через резистор 4.7 кΩ до уровня 0.143 В. После снятия нагрузки дал 3 часа на деполяризацию. За первый час напряжение поднялось до 0.655 В, потом остановилось. При этом импеданс (28 Ω) не менялся.
• После этого разобрал. Разборка ML2032 требует приложения бОльших усилий, чем CR2032. Не знаю: толи металл менее пластичный, толи уплотнительные кольца более жесткие.

• Взаимодействие с водой ограничивается выделением нескольких мелких пузырьков. Это следовые остатки лития на аноде. ВИДЕО.
Измерение pH показывает фактически нейтральную среду.
 Фотку сделал слишком поздно — верхний квадратик успел укатиться вправо до 8.0.
Фотку сделал слишком поздно — верхний квадратик успел укатиться вправо до 8.0.
• Ради интереса бросил в рюмку с водой таблетку MnO₂. Пузырьков вообще не видел, среда тоже фактически нейтральная.

• Масса минусовой крышки после купания в воде и легкой сушки не изменилась. Не хватило чувствительности весов.

 Ворсинки на правой фотке — это частицы с волокнистого сепаратора, которые «распушились» после пребывания в воде.
Ворсинки на правой фотке — это частицы с волокнистого сепаратора, которые «распушились» после пребывания в воде.
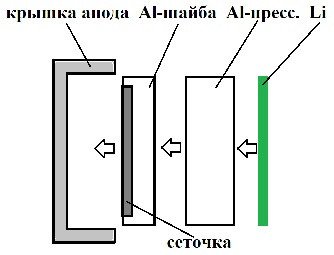
Для начала поковырял алюминий сверху. Алюминий оказался довольно твердым (наверное, сплав а-ля дюраль) и серьезно спрессованным. Мое первоначальное предположение о том, что литий при заряде покрывает (обволакивает) частицы мелкодисперсного алюминия оказалось неверным. Литий ложится слоем на поверхность прессованной «таблетки» алюминиевого порошка с гофрированием.
 Потом подковырнул алюминиевую накладку на стальной анодной крышке. Она оказалась приварена точечной сваркой.
Потом подковырнул алюминиевую накладку на стальной анодной крышке. Она оказалась приварена точечной сваркой.
 Оказалось, что прессованный алюминий находится на металлическом кружке, похожим на толстую алюминиевую фольгу (не магнитится). В сам алюминиевый кружок впечатана тонкая сеточка, скорее всего из нержавейки, не магнитится. Собственно, эта сеточка и обеспечивает надежный контакт со стальной крышкой (-).
Оказалось, что прессованный алюминий находится на металлическом кружке, похожим на толстую алюминиевую фольгу (не магнитится). В сам алюминиевый кружок впечатана тонкая сеточка, скорее всего из нержавейки, не магнитится. Собственно, эта сеточка и обеспечивает надежный контакт со стальной крышкой (-).
Вид с боку:
 Потом удалось согнуть пополам и даже переломить:
Потом удалось согнуть пополам и даже переломить:
 Вот таким хитрым способом удалось приделать алюминий к никелированной стали.
Вот таким хитрым способом удалось приделать алюминий к никелированной стали.
На самом деле, аккумуляторы пришли хорошо заряженными. У одного 3.09 В, у другого — 3.11 В. Причем, даже под нагрузкой (30Ω) напряжение просело только в 3 знаке после запятой.
Тем не менее, сделал заряд до упора на 3.3 В. В строгом соответствии с рекомендациями из [1] или [2]:
 Ограничение по току выставил на ЛБП.
Ограничение по току выставил на ЛБП.
Несколько месяцев назад в очередной раз калибровал Корад по Флюку. Ничего не изменилось.
• Напряжение Корад держит идеально.
Установка на Кораде 3.00 В → 2.9975 В показывает Флюк.
• Установка на Кораде 0.001 А → 1.7 мА — Флюк. То, что нужно. При этом амперметр Корада в ходе заряда показывает 0.000 А.
 Ток контролировал Флюком в режиме записи с интервалом 2 с., что бы понять, когда можно прервать процесс заряда.
Ток контролировал Флюком в режиме записи с интервалом 2 с., что бы понять, когда можно прервать процесс заряда.
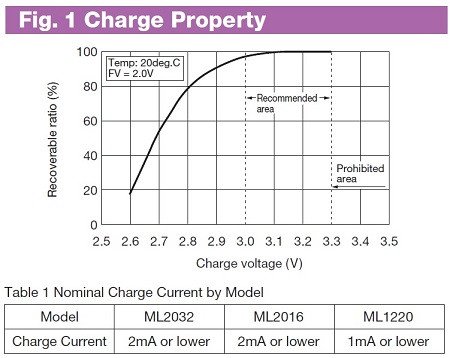
Кривая дозаряда почти полностью заряженного ML2032 получилась несколько необычная. После перехода в режим CV это не спад по обратной экспоненте, а 3 почти линейных участка с плавными переходами:
 Ну да ладно, 1/10 от верхнего ограничения (2 мА) достигнуто и достаточно.
Ну да ладно, 1/10 от верхнего ограничения (2 мА) достигнуто и достаточно.
После заряда дал отдохнуть около суток. Напряжение стабилизировалось на 3.25 В.
Вскрытие:
 Сравните с аналогичным фото для полностью разряженного ML.
Сравните с аналогичным фото для полностью разряженного ML.
Цвет нашлепки на аноде изменился на более темный серый — литий на воздухе мгновенно покрывается тонким слоем оксонитрида (см. предыдущую статью).
Взвешивание:
 Крышка анода на 0.02 г тяжелее, чем в случае полностью разряженного. По [4] и [5] лития должно быть около 0.03 г. Но разрешающая способность весов 0.01 г, так что все нормально.
Крышка анода на 0.02 г тяжелее, чем в случае полностью разряженного. По [4] и [5] лития должно быть около 0.03 г. Но разрешающая способность весов 0.01 г, так что все нормально.
Взаимодействие с водой протекает в 2 этапа.
1. Сначала довольно бурное взаимодействие лития, находящегося на поверхности алюминия.
2Li + 2H₂O = 2LiOH + H₂↑
Начало — видео
Через 2 минуты, вид сверху — видео
2. Потом взаимодействие алюминия с водой в щелочной среде, медленное и плавно затухающее. Щелочь предотвращает образование на алюминии защитной пленки.
2Al + 10H₂O + 2LiOH = 2Li[Al(OH)₄(H₂O)₂] + 3H₂↑
Оставил на ночь до прекращения выделения пузырьков водорода.
Утром обнаружил небольшое количество белой гелеобразной взвеси у дна. Это гидрат гидроксида алюминия Al(OH)₃·3H₂O.
Он образуется за счет обменной реакции
[Al(OH)₄(H₂O)₂]⁻ + H₂O = Al(OH)₃·3H₂O↓ + ОH⁻
Гидроксид-ионы ОH⁻ из правой части этого уравнения и обуславливают pH получившегося раствора.
Перемешал реакционную смесь и сделал замеры кислотности среды.
 Бумага «0-14» показала pH=8-9, бумага «4.5-9.0» pH=8.0-8.5.
Бумага «0-14» показала pH=8-9, бумага «4.5-9.0» pH=8.0-8.5.
Теперь посмотрим, что за аккумулятор получился.
Начнем с китайского даташита [7].
 Ну, то что для ML2032 заявлено 65 мАч — это стандартно уже лет 20-25.
Ну, то что для ML2032 заявлено 65 мАч — это стандартно уже лет 20-25.
Из-за того, что бОльшая часть лития заменена на алюминий, емкость «немножко» уменьшилась 220→65 мАч.
Но самое интересное — устойчивость к циклированию. Это вообще самое главное качество аккумулятора. И это единственное, что его отличает от батарейки.
Увы, тех кто проводит длительные циклирования и выкладывает результаты в интернет, можно пересчитать по пальцам…
Извините, отвлекся. Китайцы хитренькие — в сводной таблице привели циферки для глубины циклирования 10% и 20%. Кстати, обратите внимание на скачек с 1300 на 450 циклов. А на следующей странице — график все объясняющий (зеленый). Но он полулогарифмический и не всякая домохозяйка допетрит что из него следует. А следует из него жесть жестяная: при глубине циклирования 100% — только 30 циклов до заметной потери емкости (интересно — какой?).
Посмотрим, что по этому поводу декларирует Maxell в каталоге [8]***, 30 лет назад придумавший ML и с тех пор лидер в данной области. Не случайно китайцы, когда хотят закосить под фирмУ пишут исключительно «Maxell» + «Made In Japan».
Так вот, в той сводной табличке от Maxell, там сразу прямо в лоб: при 10% — выдерживает до 1000 циклов, а при 100% — до 30. Ниже — иллюстрирующий график (тоже полулогарифмический).

А то, что китайцы заявляют 1300 вместо 1000, думаю, никого не удивляет — менталитет такой. Опять же, есть совершенно легальный способ накрутить циклируемость. Все зависит от того, потеря какой части начальной емкости считать допустимой: 80%, 70% или вообще 50%? Тем паче, что сам Maxell тоже не удосужился хоть где-то обозначить сей критерий. Поэтому что 1000, что 1300 — это вилами по воде.:)
Краткий ответ: а шо вы хотели за такие деньги? Электрохимическая система такая…
Вспомнился старинный анекдот, известный с тех самых либертарианских перестроечных времен.
Давайте разбираться.
На самом деле, тут вся проблема в материале катода (+).
И истории той более 30 лет.
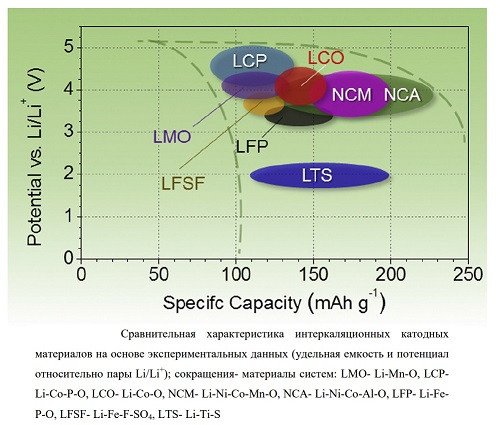
Когда в 80-х велись активные исследования с целью создания стабильно работающих и более-менее безопасных литиевых аккумуляторов, в качестве материала катода рассматривались две основные кандидатуры:
— моноклинный (слоистый) кобальтат лития LiCoO₂ или он же со структурой шпинели |статья, англ.|
— одна из фаз в системе Li-Mn-O (LMO) |статья, англ.|одна из диссертаций, рус.|
Занимались этим многие, но гонку выиграла Сони, которая в 1991 г. вышла на рынок с удачной технологией, которую назвала Li-ion.
• Главная фишка — анод был сделан из графитового порошка, который интеркалирует атомарный литий.
• В качестве катода был выбран слоистый LiCoO₂.
При этом LiCoO₂ заметно дороже и более пожаробезопасен, чем LMO. Кроме того, LiCoO₂ ядовит и с экологией не дружит. Согласитесь, довольно странный выбор.:) Что было не так с LMO? И почему LMO начал активно использоваться в Li-ion только лет через 20?
Вот об этом и поговорим далее.
Итак, трехкомпонентная система Li-Mn-O. Сколько фаз в этой системе до сих пор (!) никто толком не знает. Пока однозначно присутствуют те, которые в табличке:
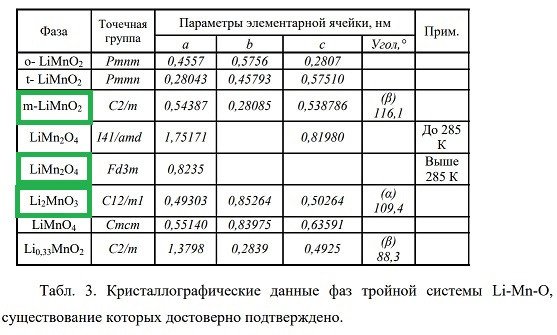 Зеленым выделены те, которые в принципе подходят для материала катода.
Зеленым выделены те, которые в принципе подходят для материала катода.
Структура у них такая:
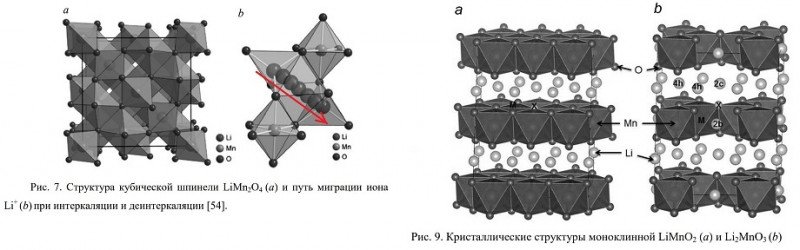 Две структуры, изображенные на рис.9 — слоистые и подобны слоистому LiCoO₂. Казалось бы — выбор почти очевиден: или (9а) или (9b). Ан нет:
Две структуры, изображенные на рис.9 — слоистые и подобны слоистому LiCoO₂. Казалось бы — выбор почти очевиден: или (9а) или (9b). Ан нет:
• Вариант (9b) Li₂MnO₃ — электрохимически неактивен, при попытке заряда литий из него не выходит (тут, табл.1)
• Вариант (9а) LiMnO₂ напрямую не получается. А если получать из MnO₂, то крайне сложно добиться плавильной стехиометрии (состава как по формуле). На даже если такое удалось, то в ходе уже первых разрядов он все равно будет активно трансформироваться в шпинель (та, которая на картинке слева).
Получается, что для LMO электрода остается пока только один вариант — LiMn₂O₄ (LiₓMn₂O₄) с кристаллической структурой шпинели. Более правильно записать эту формулу как LiMn⁺³O₂·Mn⁺⁴O₂ или хLiMn⁺³O₂·Mn⁺⁴O₂. Переменная «х» тут добавлена, так как количество атомов лития может меняться в интервале 0...1. При разряде «х» уменьшается (литий выходит в электролит в виде ионов Li⁺ и уходит к аноду). При заряде — все наоборот. Применительно к ML-аккумулятору:
 Кстати, объёмная проводимость лития через шпинель LiₓMn₂O₄ даже больше, чем в случае слоистых структуры. С этим нет проблем. Проблемы начинаются дальше. При заряде аккумулятора (Li-ion или ML — без разницы):
Кстати, объёмная проводимость лития через шпинель LiₓMn₂O₄ даже больше, чем в случае слоистых структуры. С этим нет проблем. Проблемы начинаются дальше. При заряде аккумулятора (Li-ion или ML — без разницы):
ОТСЮДА:
 При этом изменение объема составляет ~8%.
При этом изменение объема составляет ~8%.
ОТСЮДА:
 Последний момент требует пояснения.
Последний момент требует пояснения.
При заряде аккумулятора ионы Li⁺ уходят из катода. Марганец устойчив в степенях окисления +2 и +4. Степень окисления +3 промежуточная и неустойчивая. Потому он склонен к диспропорционированию. Из двух Mn⁺³ получается один Mn⁺² и один Mn⁺⁴. Это только пол беды. Главная печаль в том, что Mn⁺² может существовать как простой (одноатомный) ион. И он переходит в раствор электролита вместе с ионами Li⁺. Далее в ходе заряда он вместе с Li⁺ идет к (-) и там превращается в металлический Mn⁰. Мало того, что он загрязняет литий на аноде, он еще и понижает его потенциал. Причем, при увеличении глубины разряда это нежелательное явление усиливается катастрофически. Ведь чем глубже разряд, тем глубже и продолжительнее заряд. Отсюда и вся эта дичь, столь нехарактерная для нормальных коммерческих систем: при глубине 10% — выдерживает до 1000 циклов, а при 100% — только ~30.
В случае LiCoO₂ ничего подобного не происходит. Для кобальта характерны две степени окисления Co⁺² и Co⁺³, промежуточной не существует. Ионы Co⁺² и Co⁺³ в раствор практически не переходят.
Для улучшения электрохимических характеристик LiMn₂O₄ предложено и сейчас используется:
► замещение части Mn на другие элементы (Co, Ni, V, Cr, Zn, Mn и др.) = основной способ, т.н. допирование***
► использование наноструктурированных частиц LiMn₂O₄ (были проблемы, [6])
► использование покрытий частиц (логично, как в Энелупах, [6])
Все это приводит к удорожанию конечного изделия и применяется только при изготовлении литий-ионных аккумуляторов (а не ML), которые обозначаются как LMO. Насколько я знаю, в них шпинель LiMn₂O₄ без допирования вообще никогда не применяется и не применялась ранее. Насчет наночастиц и покрытий — я не в курсе.
Замена CR на ML того же типоразмера скорее всего бессмысленна:
► емкость ML в 3-4 раза меньше
► нужно специальное ЗУ с ограничением по току ~1-2 мА и по напряжению 3-3.3 В
► нетрудно посчитать, что для того, что бы залить 65 мА при токе 2 мА нужно 32.5 часа.;)
► понятно, что никто не будет следить за уровнем заряда; заряжать будут когда элемент уже «не тянет» из-за сильного разряда; поэтому количество циклов — несколько десятков…
Оно нам такое нужно?
Тем не менее, и для такого недоделанного аккумулятора как ML есть пара узких ниш применения: это устройства, использующие мелкие элементы питания, но обычно неразбираемые пользователями: ноутбуки (и подобное) + часы, подзаряжаемые от солнышка или движений руки (Seiko Kinetic)… И все.
По крайней мере, создателям каталога Maxell, 2025 на большее уже не хватило фантазии. Хотя пустое место для третьего примера они оставили. Вдруг, чего еще вспомнят.;))
 Правда, ML тоже не вечны и когда-нибудь обязательно сдохнут. Находятся энтузиасты, которые меняют ML на CR того же размера. Как это сделать более-менее осмысленно показано в этом видео.:)
Правда, ML тоже не вечны и когда-нибудь обязательно сдохнут. Находятся энтузиасты, которые меняют ML на CR того же размера. Как это сделать более-менее осмысленно показано в этом видео.:)
На этом всё. Всего доброго.
Поэтому любая батарейка — это аккумулятор, который пока не смогли довести до ума.
А может, и никогда не доведут.
Внимание, тут будет много электрохимии — матери всех химических источников тока.
Дисклеймер или отмазка
Несмотря на все ухищрения, часть материала получилась не самой читабельной. Но по другому нельзя — иначе изложение было бы нелогичным. За что автор искренне извиняется и предлагает не стрелять в пианиста.
Если раздел 4 не удастся осилить, то ничего страшного. Это нормально.
0. Интро
Во избежание недоразумений: сейчас в формате «2032» (20мм на 3.2мм) на рынке присутствуют следующие электрохимические системы:
• Li-MnO₂ ► батарейки CR2032 и аккумуляторы ML2032 — собственно, предмет дальнейшего обсуждения;
• Li-ion ► аккумуляторы LIR2032;
• Li-CFₓ ► батарейки ВR2032, про них было ТУТ, в самом начале. С точки зрения конечного пользователя — полный аналог CR2032, только дороже и (теоретически) чем-то замечательнее.
Примечание. Есть еще DL2032 (datasheet). Додумались до такого те же самые ребята, которые в далеком 1973-м создали антропоморфного розового кролика.
 Откуда там +70% мне не ведомо, ибо в даташите заявлены совершенно обычные «220 mAh on 15 kΩ to 2.0 V», а разрядные кривые на стандартных 0.2 мА (15 kΩ) фактически совпадают с таковыми для CR2032 от большинства остальных вендоров.
Откуда там +70% мне не ведомо, ибо в даташите заявлены совершенно обычные «220 mAh on 15 kΩ to 2.0 V», а разрядные кривые на стандартных 0.2 мА (15 kΩ) фактически совпадают с таковыми для CR2032 от большинства остальных вендоров.Относительно некой «уникальности» DL2032, есть видеоролик с русскими субтитрами, который можно легко сократить до двух слов: макетологический развод.
1. Как из CR сделали ML (в первом приближении)
Итак, есть система Li|электролит|MnO₂ и на ее основе издревле существует самая популярная батарейка-«монетка» CR2032. В конкурентах — только LR44, но в забугорной терминологии LR44 уже не «монетка», а «таблетка».;)
Не суть. Главное, что инженерам (химикам и технологам) еще в далеких 90-х была поставлена задача разработать на базе этой электрохимической системы аккумулятор. То есть, сделать гальванический элемент первого рода заметно обратимым (второго рода).
И они-таки сделали.
Прямого описания как такого добились, я пока не нашел (и вряд ли кто найдет).
Но много чего можно извлечь из косвенных данных. И выдвинуть некие предварительные предположения. Это будет в данной главе.
А в следующей — вскрытие ML в 2-х крайних состояниях заряженности и ряд моментов будет откорректировано.
Для начала нам понадобится 8 первоисточников:
[1] Аккумуляторы ML2032/ML2016/ML1220. Техническое описание от Maxell
[2] Аккумулятор ML2032: Даташит от Maxell
[3] Батарейки системы Li-MnO₂ от Maxell
[4] ML Battery: Product Safety Data Sheet от Maxell, 2010
[5] ML Battery: Product Safety Data Sheet от Maxell, 2025
[6] Перспективные катодные материалы для литий-ионных источников тока: преимущества и недостатки. «Альтернативная энергетика и экология» № 12, 2011
[7] ML2032:: Даташит от GUANGZHOU MARKYN BATTERY
[8] Каталог Maxell, 2025
①
Сравним основные токообразующие реакции (фарадеевские процессы). Если совсем по-простому, то это примерно так:
 Принципиальной разницы никакой. При разряде в обоих случаях имеем [3]:
Принципиальной разницы никакой. При разряде в обоих случаях имеем [3]:
②
Зачем в ML алюминий? Порошок Al — носитель атомов Li. Типа как графит в Li-ion аккумуляторах. То, что анод порошкообразный легко догадаться, если сравнить две картинки:
 У CR2032 один коллектор тока (со стороны порошка MnO₂), а у ML2032 уже два.
У CR2032 один коллектор тока (со стороны порошка MnO₂), а у ML2032 уже два.В CR2032 литий нанесён на минусовую крышку в виде компактной блямбы (см. предыдущую статью) и сама крышка выполняет роль коллектора. А в случае ML2032 порошкообразные электроды с двух сторон.
③
Какой состав системы (Al-Li+MnO₂)? Приблизительную оценку можно получить из [4]:
 1) Если взять верхние значения, то m(Li):m(Al):m(MnO₂)=3:20:20
1) Если взять верхние значения, то m(Li):m(Al):m(MnO₂)=3:20:20Если Li в системе 0.03 г, то Al — 0.20 г.
А соотношение Li и Al: 13% Li и 87% Al.
2) Соотношение по молям
n(3/6.9):n(20/27):n(20/87)=0.435:0.741:0.230=1:1.70:0.53
Обратите внимание, как мало (по молям) окислителя MnO₂ относительно восстановителя лития. Дело в том, что часть лития постоянно входит в состав катода LiₓMn₂O₄, независимо от уровня заряда ML. Это будет объяснено ниже.
④
Когда предыдущий пункт был полностью оформлен, я случайно забрел на сайт Maxell и с удивлением обнаружил наисвежайший ML Battery: Product Safety Data Sheet от 01.01.2025.
Теперь они декларируют такое:
 Радует, что представителям международных контролирующих органов удалось-таки объяснить составителям таблицы, что содержание базовых (абсолютно необходимых) компонентов не может начинаться с 0%.;) Кроме того, все-таки добавили данные по корпусу (сталь), уплотнителю + сепаратору (полипропилен).
Радует, что представителям международных контролирующих органов удалось-таки объяснить составителям таблицы, что содержание базовых (абсолютно необходимых) компонентов не может начинаться с 0%.;) Кроме того, все-таки добавили данные по корпусу (сталь), уплотнителю + сепаратору (полипропилен).В Product Safety производители вынуждены заявлять хотя бы сильно приблизительный состав компонентов ячеек. Иначе аккредитацию не пройдут и соответствующий значок не получат. Но при этом точная «рецептура» — есть коммерческая тайна. Правда, куда как меньшая, чем «хау ит мейд» (технология изготовления).
⑤
Пока могу предположить как делают ML-аккумуляторы, начиная с 1996 г. (Maxell)
Изначально анод (-) представляет собой слегка отпрессованный мелкодисперсный порошок Al. Типа алюминиевой пудры, но специально обработанной для увеличения площади поверхности и удаления избытка защитной пленки оксида алюминия.
А катод (+) изначально — слабо отпрессованный мелкодисперсный порошок шпинели LiMn₂O₄.
После герметизации ячейки производят первичный заряд. Часть лития уходит на (-) и покрывает поверхность алюминиевой матрицы.
2. Опыты
План был такой
1) Купить пару ML2032. Желательно с надписью «Maxell»***.
✅ Выполнено:

***
Понятно, что на славной Гонконгщине есть не одна сотня Малых Арнаутских, где легко могут прилепить любой лейбл на что угодно. Да еще и «Маде ин Джапан» в придачу… Но все-таки, а вдруг и вправду Джапан?
2) Купить более-менее вменяемую универсальную индикаторную бумагу
✅ Выполнено:

Некоторые замечания
Ну, насколько эта сладкая парочка относится к категории «лакмусовая бумага», обсуждать несколько бессмысленно. Те, кто понимает — тот понимает. Остальным — просто без разницы как оно называется, лишь бы pH. :)
Обычная универсальная индикаторная бумага (желтая) — одношкальная.
А сабжевыми многошкальными бумагами надо немного понимать как работать. Во времена СЭВ такие выпускались химпромами ЧССР и ГДР, причем шаг по pH мог доходить до 0.1. Но время хранения — не более 1-2 лет. На полученных изделиях славного китайпрома отметки о дате изготовления нет.
Проверка на чистой воде показала, что бумага «0-14» в нейтральной среде ведет себя несколько неадекватно и (возможно) является лажой и в других средах.
Бумага «4.5-9.0» оказалась более удобоваримой. Но с одним нюансом: первые 5-10 сек она уходит по pH в кислую сторону (на 0.25), еще через 10-15 сек показывает нечто похожее на правду, потом заваливается (на 0.25) в слабощелочную среду. А еще через 3-5 мин. начинает показывать абы что.
Обычная универсальная индикаторная бумага (желтая) — одношкальная.
А сабжевыми многошкальными бумагами надо немного понимать как работать. Во времена СЭВ такие выпускались химпромами ЧССР и ГДР, причем шаг по pH мог доходить до 0.1. Но время хранения — не более 1-2 лет. На полученных изделиях славного китайпрома отметки о дате изготовления нет.
Проверка на чистой воде показала, что бумага «0-14» в нейтральной среде ведет себя несколько неадекватно и (возможно) является лажой и в других средах.
Бумага «4.5-9.0» оказалась более удобоваримой. Но с одним нюансом: первые 5-10 сек она уходит по pH в кислую сторону (на 0.25), еще через 10-15 сек показывает нечто похожее на правду, потом заваливается (на 0.25) в слабощелочную среду. А еще через 3-5 мин. начинает показывать абы что.
3) Один ML зарядить до упора. Другой — разрядить «практически в ноль». После этого вскрыть, взвесить «минусовые» крышки и бросить их в воду. Вынуть, высушить, взвесить. В общем, все как в предыдущем материале. Единственное отличие — замерить pH получившихся растворов.
4) Обработать полученные результаты, посмотреть как оно там устроено и, возможно, просчитать состав анода.
2.1 Полностью разряженный ML2032
Разряжал 9 суток (без 2 часов) через резистор 4.7 кΩ до уровня 0.143 В. После снятия нагрузки дал 3 часа на деполяризацию. За первый час напряжение поднялось до 0.655 В, потом остановилось. При этом импеданс (28 Ω) не менялся.
• После этого разобрал. Разборка ML2032 требует приложения бОльших усилий, чем CR2032. Не знаю: толи металл менее пластичный, толи уплотнительные кольца более жесткие.

• Взаимодействие с водой ограничивается выделением нескольких мелких пузырьков. Это следовые остатки лития на аноде. ВИДЕО.
Измерение pH показывает фактически нейтральную среду.
 Фотку сделал слишком поздно — верхний квадратик успел укатиться вправо до 8.0.
Фотку сделал слишком поздно — верхний квадратик успел укатиться вправо до 8.0.• Ради интереса бросил в рюмку с водой таблетку MnO₂. Пузырьков вообще не видел, среда тоже фактически нейтральная.

• Масса минусовой крышки после купания в воде и легкой сушки не изменилась. Не хватило чувствительности весов.

 Ворсинки на правой фотке — это частицы с волокнистого сепаратора, которые «распушились» после пребывания в воде.
Ворсинки на правой фотке — это частицы с волокнистого сепаратора, которые «распушились» после пребывания в воде.2.2 Как устроен анод (-)
Для начала поковырял алюминий сверху. Алюминий оказался довольно твердым (наверное, сплав а-ля дюраль) и серьезно спрессованным. Мое первоначальное предположение о том, что литий при заряде покрывает (обволакивает) частицы мелкодисперсного алюминия оказалось неверным. Литий ложится слоем на поверхность прессованной «таблетки» алюминиевого порошка с гофрированием.
 Потом подковырнул алюминиевую накладку на стальной анодной крышке. Она оказалась приварена точечной сваркой.
Потом подковырнул алюминиевую накладку на стальной анодной крышке. Она оказалась приварена точечной сваркой. Оказалось, что прессованный алюминий находится на металлическом кружке, похожим на толстую алюминиевую фольгу (не магнитится). В сам алюминиевый кружок впечатана тонкая сеточка, скорее всего из нержавейки, не магнитится. Собственно, эта сеточка и обеспечивает надежный контакт со стальной крышкой (-).
Оказалось, что прессованный алюминий находится на металлическом кружке, похожим на толстую алюминиевую фольгу (не магнитится). В сам алюминиевый кружок впечатана тонкая сеточка, скорее всего из нержавейки, не магнитится. Собственно, эта сеточка и обеспечивает надежный контакт со стальной крышкой (-).Вид с боку:
 Потом удалось согнуть пополам и даже переломить:
Потом удалось согнуть пополам и даже переломить: Вот таким хитрым способом удалось приделать алюминий к никелированной стали.
Вот таким хитрым способом удалось приделать алюминий к никелированной стали.
2.3 Полностью заряженный ML2032
На самом деле, аккумуляторы пришли хорошо заряженными. У одного 3.09 В, у другого — 3.11 В. Причем, даже под нагрузкой (30Ω) напряжение просело только в 3 знаке после запятой.
Тем не менее, сделал заряд до упора на 3.3 В. В строгом соответствии с рекомендациями из [1] или [2]:
 Ограничение по току выставил на ЛБП.
Ограничение по току выставил на ЛБП.Несколько месяцев назад в очередной раз калибровал Корад по Флюку. Ничего не изменилось.
• Напряжение Корад держит идеально.
Установка на Кораде 3.00 В → 2.9975 В показывает Флюк.
• Установка на Кораде 0.001 А → 1.7 мА — Флюк. То, что нужно. При этом амперметр Корада в ходе заряда показывает 0.000 А.
 Ток контролировал Флюком в режиме записи с интервалом 2 с., что бы понять, когда можно прервать процесс заряда.
Ток контролировал Флюком в режиме записи с интервалом 2 с., что бы понять, когда можно прервать процесс заряда. Кривая дозаряда почти полностью заряженного ML2032 получилась несколько необычная. После перехода в режим CV это не спад по обратной экспоненте, а 3 почти линейных участка с плавными переходами:
 Ну да ладно, 1/10 от верхнего ограничения (2 мА) достигнуто и достаточно.
Ну да ладно, 1/10 от верхнего ограничения (2 мА) достигнуто и достаточно.После заряда дал отдохнуть около суток. Напряжение стабилизировалось на 3.25 В.
Вскрытие:
 Сравните с аналогичным фото для полностью разряженного ML.
Сравните с аналогичным фото для полностью разряженного ML.Цвет нашлепки на аноде изменился на более темный серый — литий на воздухе мгновенно покрывается тонким слоем оксонитрида (см. предыдущую статью).
Взвешивание:
 Крышка анода на 0.02 г тяжелее, чем в случае полностью разряженного. По [4] и [5] лития должно быть около 0.03 г. Но разрешающая способность весов 0.01 г, так что все нормально.
Крышка анода на 0.02 г тяжелее, чем в случае полностью разряженного. По [4] и [5] лития должно быть около 0.03 г. Но разрешающая способность весов 0.01 г, так что все нормально.Взаимодействие с водой протекает в 2 этапа.
1. Сначала довольно бурное взаимодействие лития, находящегося на поверхности алюминия.
2Li + 2H₂O = 2LiOH + H₂↑
Начало — видео
Через 2 минуты, вид сверху — видео
2. Потом взаимодействие алюминия с водой в щелочной среде, медленное и плавно затухающее. Щелочь предотвращает образование на алюминии защитной пленки.
2Al + 10H₂O + 2LiOH = 2Li[Al(OH)₄(H₂O)₂] + 3H₂↑
Оставил на ночь до прекращения выделения пузырьков водорода.
Утром обнаружил небольшое количество белой гелеобразной взвеси у дна. Это гидрат гидроксида алюминия Al(OH)₃·3H₂O.
Он образуется за счет обменной реакции
[Al(OH)₄(H₂O)₂]⁻ + H₂O = Al(OH)₃·3H₂O↓ + ОH⁻
Гидроксид-ионы ОH⁻ из правой части этого уравнения и обуславливают pH получившегося раствора.
Перемешал реакционную смесь и сделал замеры кислотности среды.
 Бумага «0-14» показала pH=8-9, бумага «4.5-9.0» pH=8.0-8.5.
Бумага «0-14» показала pH=8-9, бумага «4.5-9.0» pH=8.0-8.5.В принципе, можно и посчитать. Что бы убедиться в очевидном
Пусть pH=9
pH+pОH=14 (если t=24.87ºС)
pОH=14-9=5
pОH=-lg[ОH⁻] (по определению)
[ОH⁻]=10⁻⁵ моль/л
По уравнению реакции из 1 моль Li получается 1 моль LiОН.
LiОН — щелочь, на ионы распадается полностью и необратимо => из 1 моль LiОН получается 1 моль OH⁻.
m(Li)=10⁻⁵ моль, если бы он растворился в 1 л воды.
V(воды)=0.574 л
n(Li)=1.74х10⁻⁵ моль
М(Li)=6.941 г/моль
m(Li)=6.941х1.74х10⁻⁵=0.121х10⁻³=0.00012 г
А на самом деле m(Li)~0.02 г, т.е. в 170 раз больше.
Что это означает? Почти все гидроксид-ионы ОH⁻, получившиеся при взаимодействии Li с водой ушли на взаимодействие Al с водой. Причем на 1 атом Al, растворяющегося в воде, расходуется 3 иона ОH⁻.
pH+pОH=14 (если t=24.87ºС)
pОH=14-9=5
pОH=-lg[ОH⁻] (по определению)
[ОH⁻]=10⁻⁵ моль/л
По уравнению реакции из 1 моль Li получается 1 моль LiОН.
LiОН — щелочь, на ионы распадается полностью и необратимо => из 1 моль LiОН получается 1 моль OH⁻.
m(Li)=10⁻⁵ моль, если бы он растворился в 1 л воды.
V(воды)=0.574 л
n(Li)=1.74х10⁻⁵ моль
М(Li)=6.941 г/моль
m(Li)=6.941х1.74х10⁻⁵=0.121х10⁻³=0.00012 г
А на самом деле m(Li)~0.02 г, т.е. в 170 раз больше.
Что это означает? Почти все гидроксид-ионы ОH⁻, получившиеся при взаимодействии Li с водой ушли на взаимодействие Al с водой. Причем на 1 атом Al, растворяющегося в воде, расходуется 3 иона ОH⁻.
3. Что имеем в результате
Теперь посмотрим, что за аккумулятор получился.
Начнем с китайского даташита [7].
 Ну, то что для ML2032 заявлено 65 мАч — это стандартно уже лет 20-25.
Ну, то что для ML2032 заявлено 65 мАч — это стандартно уже лет 20-25.Из-за того, что бОльшая часть лития заменена на алюминий, емкость «немножко» уменьшилась 220→65 мАч.
Но самое интересное — устойчивость к циклированию. Это вообще самое главное качество аккумулятора. И это единственное, что его отличает от батарейки.
Увы, тех кто проводит длительные циклирования и выкладывает результаты в интернет, можно пересчитать по пальцам…
Извините, отвлекся. Китайцы хитренькие — в сводной таблице привели циферки для глубины циклирования 10% и 20%. Кстати, обратите внимание на скачек с 1300 на 450 циклов. А на следующей странице — график все объясняющий (зеленый). Но он полулогарифмический и не всякая домохозяйка допетрит что из него следует. А следует из него жесть жестяная: при глубине циклирования 100% — только 30 циклов до заметной потери емкости (интересно — какой?).
Посмотрим, что по этому поводу декларирует Maxell в каталоге [8]***, 30 лет назад придумавший ML и с тех пор лидер в данной области. Не случайно китайцы, когда хотят закосить под фирмУ пишут исключительно «Maxell» + «Made In Japan».
Так вот, в той сводной табличке от Maxell, там сразу прямо в лоб: при 10% — выдерживает до 1000 циклов, а при 100% — до 30. Ниже — иллюстрирующий график (тоже полулогарифмический).

***
На самом деле, в Maxell жуки еще те:
— в даташите [2] и в техописании [1] есть про 10% — 1000 циклов и 20% — 300 циклов, а про 100% скромно умолчали.;)
— в даташите [2] и в техописании [1] есть про 10% — 1000 циклов и 20% — 300 циклов, а про 100% скромно умолчали.;)
А то, что китайцы заявляют 1300 вместо 1000, думаю, никого не удивляет — менталитет такой. Опять же, есть совершенно легальный способ накрутить циклируемость. Все зависит от того, потеря какой части начальной емкости считать допустимой: 80%, 70% или вообще 50%? Тем паче, что сам Maxell тоже не удосужился хоть где-то обозначить сей критерий. Поэтому что 1000, что 1300 — это вилами по воде.:)
4. Почему циклируемость ML такая паршивая?
Краткий ответ: а шо вы хотели за такие деньги? Электрохимическая система такая…
Вспомнился старинный анекдот, известный с тех самых либертарианских перестроечных времен.
Дополнительная информация
Закончился концерт симфонического оркестра. После концерта к музыканту, который сидит на большом барабане с колотушкой подходит серьезный человек с удостоверением и спрашивает:
— Вы знаете, я наблюдал за Вами на протяжении всего концерта. За это время Вы стукнули в барабан всего два раза.
— Понимаете, товарищ, партия у меня такая…
— Партия у нас у всех — одна. А стучать надо чаще.
— Вы знаете, я наблюдал за Вами на протяжении всего концерта. За это время Вы стукнули в барабан всего два раза.
— Понимаете, товарищ, партия у меня такая…
— Партия у нас у всех — одна. А стучать надо чаще.
Давайте разбираться.
На самом деле, тут вся проблема в материале катода (+).
И истории той более 30 лет.
Когда в 80-х велись активные исследования с целью создания стабильно работающих и более-менее безопасных литиевых аккумуляторов, в качестве материала катода рассматривались две основные кандидатуры:
— моноклинный (слоистый) кобальтат лития LiCoO₂ или он же со структурой шпинели |статья, англ.|
— одна из фаз в системе Li-Mn-O (LMO) |статья, англ.|одна из диссертаций, рус.|
Занимались этим многие, но гонку выиграла Сони, которая в 1991 г. вышла на рынок с удачной технологией, которую назвала Li-ion.
• Главная фишка — анод был сделан из графитового порошка, который интеркалирует атомарный литий.
• В качестве катода был выбран слоистый LiCoO₂.
При этом LiCoO₂ заметно дороже и более пожаробезопасен, чем LMO. Кроме того, LiCoO₂ ядовит и с экологией не дружит. Согласитесь, довольно странный выбор.:) Что было не так с LMO? И почему LMO начал активно использоваться в Li-ion только лет через 20?
Вот об этом и поговорим далее.
Итак, трехкомпонентная система Li-Mn-O. Сколько фаз в этой системе до сих пор (!) никто толком не знает. Пока однозначно присутствуют те, которые в табличке:
 Зеленым выделены те, которые в принципе подходят для материала катода.
Зеленым выделены те, которые в принципе подходят для материала катода.Структура у них такая:
 Две структуры, изображенные на рис.9 — слоистые и подобны слоистому LiCoO₂. Казалось бы — выбор почти очевиден: или (9а) или (9b). Ан нет:
Две структуры, изображенные на рис.9 — слоистые и подобны слоистому LiCoO₂. Казалось бы — выбор почти очевиден: или (9а) или (9b). Ан нет:• Вариант (9b) Li₂MnO₃ — электрохимически неактивен, при попытке заряда литий из него не выходит (тут, табл.1)
• Вариант (9а) LiMnO₂ напрямую не получается. А если получать из MnO₂, то крайне сложно добиться плавильной стехиометрии (состава как по формуле). На даже если такое удалось, то в ходе уже первых разрядов он все равно будет активно трансформироваться в шпинель (та, которая на картинке слева).
Получается, что для LMO электрода остается пока только один вариант — LiMn₂O₄ (LiₓMn₂O₄) с кристаллической структурой шпинели. Более правильно записать эту формулу как LiMn⁺³O₂·Mn⁺⁴O₂ или хLiMn⁺³O₂·Mn⁺⁴O₂. Переменная «х» тут добавлена, так как количество атомов лития может меняться в интервале 0...1. При разряде «х» уменьшается (литий выходит в электролит в виде ионов Li⁺ и уходит к аноду). При заряде — все наоборот. Применительно к ML-аккумулятору:
 Кстати, объёмная проводимость лития через шпинель LiₓMn₂O₄ даже больше, чем в случае слоистых структуры. С этим нет проблем. Проблемы начинаются дальше. При заряде аккумулятора (Li-ion или ML — без разницы):
Кстати, объёмная проводимость лития через шпинель LiₓMn₂O₄ даже больше, чем в случае слоистых структуры. С этим нет проблем. Проблемы начинаются дальше. При заряде аккумулятора (Li-ion или ML — без разницы):ОТСЮДА:
 При этом изменение объема составляет ~8%.
При этом изменение объема составляет ~8%. ОТСЮДА:
 Последний момент требует пояснения.
Последний момент требует пояснения.При заряде аккумулятора ионы Li⁺ уходят из катода. Марганец устойчив в степенях окисления +2 и +4. Степень окисления +3 промежуточная и неустойчивая. Потому он склонен к диспропорционированию. Из двух Mn⁺³ получается один Mn⁺² и один Mn⁺⁴. Это только пол беды. Главная печаль в том, что Mn⁺² может существовать как простой (одноатомный) ион. И он переходит в раствор электролита вместе с ионами Li⁺. Далее в ходе заряда он вместе с Li⁺ идет к (-) и там превращается в металлический Mn⁰. Мало того, что он загрязняет литий на аноде, он еще и понижает его потенциал. Причем, при увеличении глубины разряда это нежелательное явление усиливается катастрофически. Ведь чем глубже разряд, тем глубже и продолжительнее заряд. Отсюда и вся эта дичь, столь нехарактерная для нормальных коммерческих систем: при глубине 10% — выдерживает до 1000 циклов, а при 100% — только ~30.
В случае LiCoO₂ ничего подобного не происходит. Для кобальта характерны две степени окисления Co⁺² и Co⁺³, промежуточной не существует. Ионы Co⁺² и Co⁺³ в раствор практически не переходят.
Для улучшения электрохимических характеристик LiMn₂O₄ предложено и сейчас используется:
► замещение части Mn на другие элементы (Co, Ni, V, Cr, Zn, Mn и др.) = основной способ, т.н. допирование***
► использование наноструктурированных частиц LiMn₂O₄ (были проблемы, [6])
► использование покрытий частиц (логично, как в Энелупах, [6])
***Пример
К примеру, англоязычная статья, написанная 15 китайскими товарищами. Цель проста: уменьшение размаха колебаний объема шпинели при циклировании. Для этого они сделали двойное допирование: Co и Al. В результате растрескивание зерен шпинели LiₓMn₂O₄ было существенно подавлено


Все это приводит к удорожанию конечного изделия и применяется только при изготовлении литий-ионных аккумуляторов (а не ML), которые обозначаются как LMO. Насколько я знаю, в них шпинель LiMn₂O₄ без допирования вообще никогда не применяется и не применялась ранее. Насчет наночастиц и покрытий — я не в курсе.

5. Области применения ML
Замена CR на ML того же типоразмера скорее всего бессмысленна:
► емкость ML в 3-4 раза меньше
► нужно специальное ЗУ с ограничением по току ~1-2 мА и по напряжению 3-3.3 В
► нетрудно посчитать, что для того, что бы залить 65 мА при токе 2 мА нужно 32.5 часа.;)
► понятно, что никто не будет следить за уровнем заряда; заряжать будут когда элемент уже «не тянет» из-за сильного разряда; поэтому количество циклов — несколько десятков…
Оно нам такое нужно?
Тем не менее, и для такого недоделанного аккумулятора как ML есть пара узких ниш применения: это устройства, использующие мелкие элементы питания, но обычно неразбираемые пользователями: ноутбуки (и подобное) + часы, подзаряжаемые от солнышка или движений руки (Seiko Kinetic)… И все.
По крайней мере, создателям каталога Maxell, 2025 на большее уже не хватило фантазии. Хотя пустое место для третьего примера они оставили. Вдруг, чего еще вспомнят.;))
 Правда, ML тоже не вечны и когда-нибудь обязательно сдохнут. Находятся энтузиасты, которые меняют ML на CR того же размера. Как это сделать более-менее осмысленно показано в этом видео.:)
Правда, ML тоже не вечны и когда-нибудь обязательно сдохнут. Находятся энтузиасты, которые меняют ML на CR того же размера. Как это сделать более-менее осмысленно показано в этом видео.:)На этом всё. Всего доброго.
Самые обсуждаемые обзоры
| +112 |
4229
134
|
| +73 |
3604
75
|
Ну, и и прибыль тоже )
Но потом все резко заглохло...;)
Спасибо, я всегда подозревал, что батарейки можно заряжать.
а как их заряжать и насколько это эффективно?
Т.ч. не стоит пытаться. Я пробовал, знаю, что говорю ;)
Второй месяц экспериментирую с CR2032, никаких взрывов даже рядом.
Максимум до чего пока дошел — 15В, 1.5 часа. Небольшой разогрев в нижней части держателя присутствует. Вскрытие показывает накопление весьма малого количества восстановленного лития со стороны анода.
Если все срастется, сделаю статью. Или в след. месяце или позже.
В ноутбуках ML1220 заряжается током менее 1мА до 3,2В. Потребление там микроамперы. Получается что батарейка CR2032 будет разряжаться минимально, а затем подзаряжаться всего до 3,2В. Вывод: можно просто ML1220 заменить CR2032 вообще без переделки схемы. Согласны?
вот самовскрывшиеся щелочные таблетки иногда попадаются. но это происходит тихо.
В свое время делал пару статей по LR44 (1, 2) и у меня осталось 30+ разряженных в ноль LR44 от 6 разных вендоров, которые были свалены в одну коробочку без крышки (собирался отнести на утилизацию).
Так вот, по прошествии нескольких недель они раз в день-два начали по одной самовскрываться. Какие-то просто с треском, но оставались в коробке. А некоторые с треском и полетом по кабинету (я там обитаю). Через месяц мне надоело пугаться и я их утилизировал.
Кстати, в случае CR2032 ничего такого никогда не наблюдалось. Хотя их я поперепортил заметно больше за последние несколько лет.:)
Всё понятно на самом деле.
За замену аккумулятора в официальном сервисе попросили 50 тысяч
Купил на Али за 4. По виду оригинал. Да и часы работают с ним :)
Что там у него внутри не интересовался.
Да не такая уж и заоблачная цена. 10 штук на ali ~300 рублей (+124 доставка).
Только мне пока не понятно, где их использовать.
Вы про емкость 20 мАч, конечно, в курсе? ;)
Сейчас обычно заявляют 220 мАч.
Макселл как всегда впереди планеты всей. Лет 15 назад выпустил CR2032H — 240 мАч.
1 янв 2025 анонсирован CR2032S — 250 мАч + доп. устойчивость к «высокотоковым» импульсным нагрузкам…
Про ценники на такое даже не спрашивайте.;)
У CR2032 номинальное напряжение 3.0В, а у LIR2032 — 3.6В (они литий-ионные).
в ах...крайне впечатлен.Даже пару новых слов узнал )
Скажите, вы выкладываете свои исследования на каких-то профильных ресурсах?
На PlusPda тут у вас 1.5 оппонента может найдется (это не точно)…
А такой фундаментальный труд достоин мнения узких спецов.
— основные моменты давно общеизвестны
— а как слеплен анод в ML, они сами могут разломать и посмотреть))
Было интересно читать, с вами как с Кирычем, можно влепить «плюсики» и в избранное не глядя, и в свободное время спокойно прочитать.
Короче задумался ещё больше и забил болт. Ибо расход в общей сложности 4 CR2032 в год. В «Ленте» это 2 блистера по 2 шт по 69.99р.
Заказал пару штук для пробы, пока едут…
Вот думаю а как их лучше заряжать? У них тоже ограничение есть по току зарядки?
както суховато… :)
пы.сы. у меня был опыт чтения учебников высших учебных заведений из СНГ и потенциального противника. Читаешь наши — ничего не понятно, вот как у автора статьи. Открываешь английские, на той-же теме и все понятно, даже с моим London is the capital.
Если что, ясно излагать тоже не умею.
бездарногоначинающего копирайтера. Достаточно взглянуть на несколько фраз, чтобы узреть «нечеловеческий язык».Не проще ли написать что элемент питания мал и поместится в любом приборе.
Мангана? ИИ открыл новый хим.элемент? Может лучше написать, что аккумулятор при своей миниатюрности обладает хорошей энергоемкостью?
Неужели китайцы их собирают вручную и по нескольку сотен таких вот экзотических элементов в неделю?
…
Как итог. Критиковать нужно с умом. Тогда будет виден результат.
Только вот альтернатива какая-то странная :))
pdf2.datasheet.su/panasonic/vl2020-1vc.pdf
Есть вопрос — у меня есть похожие индикаторные полоски. Как правильно определить при помощи них PH геля, если гель растворяется только в спирте, а нанести просто гель на полоску не вариант, ибо оно пропитывает бумагу крайне плохо. Т.е. я так пониманию берем какой-то конкретное значение в граммах геля и определенное количество спирта, растворяем и потом как-то пересчитываем обратно PH зная массу геля? У меня тут знаний по химии не хватает :)
Может, вам и не нужно знать рН геля?
Обрисуйте задачу или проблему в целом.
ссылка
оно?
только как это сделать в домашних условиях — ?
1) Гидроксид тетрабутиламмония стоит очень дорого + не понятно где брать
2) Надо городить спец установку для потенциометрического титрования (ссылка), там проблема – где брать спец электроды + ихняя цена.
По методу В:
1) Нужно проверить растворимость флюса в перечисленных растворителях (из документа).
Перед проверкой (и потом перед титрованием) из всех р-рителей нужно удалить следы влаги. Например, медицинский спирт ее содержит овер-дофига. Для удаления хорошо подойдут осушители в пакетиках на основе хлорида кальция безводного (в прошлом году был обзор от РесСет). Силикагель — полная фигня. Наверное, хлорид кальция лучше высыпать прямо в орг. р-ритель и тщательно перемешивать. Индикатор отсутствия влаги – обезвоженный сульфат меди (отожжённый медный купорос) белого цвета. Если влага есть, он меняет окраску на бледно-голубой (обратно в белый не восстанавливается).
2) Нужно надыбать бюретку с ценой деления 0.1 мл. Если есть знакомые:
во многих лабораториях, где проводят анализы химические или биологические (начиная с ближайшей больницы или поликлиники)
3) Нужно надыбать мерные колбы для приготовления аликвот (точных объемов жидкости) – это не градуированная колба, а сосуд с 1 риской – это точный объем, написанный на колбе.
4) Желательно обзавестись магнитной мешалкой. Вручную перемешивать десятки минут, а то и пару часов (до достижения равновесия) – задолбаетесь.
5) Инструкцию по приготовлению фенолфталеина в орг. р-рителе вышлю позже, когда будет выполнен этот блок работ.
Для связи – личка или почта в профиле.
Успехов.
для точного дозирования жидкости небольшого обьема есть такое
А что вы думаете в плане изготовить самостоятельно ph-метр?
www.youtube.com/watch?v=rkgUStPq6g4
Добро пожаловать в ад.))
Техника работы с мерной посудой. Основы титриметрического анализа
Введение в титрование (видео 1)| Титриметрический анализ
весь плейлист (выборочно): ссылка
Дичь какая-то. Проще купить готовый и калиброванный.
хороший, но дороговатый.
Но ph-метр нам нафиг не нужен, ибо он есть потенциометр, отградуированный под рН водных р-ров.
Расчёт pH раствора в неводных растворителях
+ Проблемки
Вообще, я пока не понимаю, что за значения pH китайцы указывают на этикетках флюсов. Берут кислотное число, полученное по рассматриваемой методике и переводят в pH водного раствора??
Да, еще нужен КОН и р-ритель для него. Учтите, что р-ры КОН долго хранить не желательно, он поглощает углекислоту из воздуха.
серьезные производители по методикам, которые обсуждали выше. Как китайцы — только им ведомо. Вообще суть была в том, что очень много известных флюсов подделываются китайцами и продаются как оригинал. Думал какие-то обьективные методы сравнения иметь
Там что указывается — кислотное число или pH?
xonstorage.blob.core.windows.net/pdf/3730668_link.pdf
Говорят, что этот товарищ умер.
В последнем абзаце статьи есть ссылка на видео, где один товарищ менял ML на CR. Он все понятно рассказал и показал, со схемами.
хуже не будет.
Нашел только модуль сразу на 3 батарейки
Не любая, есть и необратимые реакции, например, взрыв ВВ. Из продуктов взрыва, например, тротила, никакими манипуляциями ни одной его молекулы обратно не получишь.
За обзор +.
Нет таких реакций в химии. Есть "практически необратимые реакции" при данных условиях.
Чувствуете разницу?;)
Взрыв ВВ в герметичной взрывной камере ничего не изменит. Получите внутри смесь газов из которых исходное ВВ обратно не получить никак, какую бы энергию к продуктам взрыва не прикладывали. Хоть что с ними делай, нагревай, меняй давление, электрические разряды пропускай или ещё что то — ни одной молекулы исходного ВВ не получить, в принципе.
Просто при взрыве сложная система перешла из термодинамически крайне невыгодного состояния (ВВ), но кинетически временно устойчивого, в термодинамически устойчивое. Обратно никак.
Можно и попроще случай необратимой реакции рассмотреть, например, разложение при нагревании бертолетовой соли: KClO3 = КCl + 1.5O2.
Из конечных продуктов тоже невозможно получить исходное вещество, какие воздействия к ним не прикладывай.
Просто кроме обратимых реакций есть ещё и необратимые.
Причины:
— нет полной изолированности системы (а этого крайне трудно добиться)
— процесс многостадийный с ветвлениями
— идет не одна реакция, а множество
— наличие в системе твердой фазы => межфазной поверхности раздела
Вы пробовали осуществить это в бомбе? Там степень обратимости ~100%. ))
Обратимые и необратимые реакции это не я придумал, это общераспространённые термины из химии.
Ну если мне не верите, посмотрите хотя бы в интернете.
Вот Вам, навскидку, в помощь пару примеров:
Хим.фак Самарского университета.
eni.ssau.ru/chem/tipy-himicheskih-reakczij-v-neorganicheskoj-himii/#0
Лекция для учителей в журнале «Химия» некоего Л. Гузея.
him.1sept.ru/article.php?ID=200501802
Причём ряд примеров у них не очень удачные, для них можно подобрать условия обратимости.
Но тротил или гексоген из их продуктов взрыва обратно получить невозможно. Как и бертолетку из хлорида калия и кислорода. Удивительно, что это Вам неочевидно.
Увы, Вы только начали интересоваться химией.
К сожалению, по интернетам многое Вы поймете превратно.
Но Ваш интерес похвален.)
Школьная программа, 8 класс. ЕГЭ.
На самом химфаке должно изучаться то, что мною изложено выше.
Начало впечатляющее))
Всё с Вами ясно :(.
До сего момента я не знал, кто такой Л. Гузей, но посмотрел, благо в интернете про него даже страничка в Википедии есть.
Оказывается уже почивший известный химик — доктор химических наук, профессор кафедры общей химии химического факультета МГУ, автор нескольких учебников по химии.
Ну и кто тут химически безграмотный и больной, он или Вы?
Это, конечно, очень сильно заявлять что «все кругом п…, а я один Д'Артаньян» и при этом не иметь за душой вообще ничего, ни веских аргументов, ни даже элементарных знаний. Но теперь уже, хочешь, не хочешь, а к Вашим здесь публикациям придётся относится критически, ибо можно нарваться на явную ерунду.
И в правду, не надо было мне стрелять в пианиста, он играет как может :).
Думаю (надеюсь), что Л. Гузей к тем потокам сознания, которые я выше выделил красным, не имеет никакого отношения. Какой-то ИИ в полный рост, хотя Л.С. почил в бозе летом 2014. Конечно, возможен старческий маразм, но для людей, постоянно работающих в вузах сие крайне малохарактерно.
Лучше их вообще не читайте. Не в коня корм.
Там вообще-то журнал от 2005 г., тогда про ИИ в сети ещё не говорили, а сами эти лекции Гузея «Фундаментальные понятия общей химии в школьном курсе» были позднее изданы в печатном виде. Можете их легко скачать в сети.
А то что Вы выделили красным, это всего лишь показатель того, что Вы не понимаете смысла написанного! Мне лично там всё понятно и даже пример с сульфидом ртути у Гузея хороший.
Так что, тот самый это Гузей, настоящий :).
Но дело даже не в конкретном Гузее, примерно тоже самое найдёте и у других авторов, маститых и признанных докторов и кандидатов химических наук. Поищите поиском в сети.
Отрицать существование необратимых реакций
это как против ветра мочиться.
Ну почему же не читать. Интересно бывает пишите, познавательно, например, как из батарейки литий добывали.
Просто держать в уме, что автор не имеет фундаментальных базовых химических знаний и иногда может нести ахинею.
Если туда вкорячить обычную батарейку 2032, то:
1) не долбанёт?
2) надолго хватит?
б) цена за шт на ebay офигенна! (это и за десяток — дофига )
Сам обычно меняю сдохшие в старых ноутах батарейки «под пайку» на 2032, установленные в «кроватку» (добывается из старых материнок). Кроватка располагается\приклеивается в удобном месте (в старых ноутах пустых полостей предостаточно) и соединяется проводами нужной длины с материнкой ноута (про полярность не забываем!).
Primary batteries — Part 4: Safety of lithium batteries
webstore.iec.ch/en/publication/27465
Например CR1632 допускает по этому стандарту ток заряда (Maximum Abnormal Charge Current) в 4мА.